mRNA技術和遞送系統在新型療法中的當前概況
- 作者:呂瑞旻、徐祥恩、Ser John Lynon P. Perez、Monika Kumari、陳冠宏、洪銘祥、林音秀、劉靜航、柯釋涵、Christian Angelo P. Concio、蘇儀真、張亦函、李文山、吳漢忠
- 期刊: Journal of Biomedical Science https://doi.org/10.1186/s12929-024-01080-z
mRNA 技術在全球COVID-19疫情期間展示了令人矚目的潛力,但其未來的臨床應用仍然面臨許多挑戰。因此 Journal of Biomedical Science期刊之編輯特約邀稿,請吳漢忠特聘研究員撰寫綜述文章,深入回顧mRNA 技術設計的疫苗和治療藥物,以及遞送系統的最新進展,並探討了該領域面臨的挑戰和未來展望,內容如下:
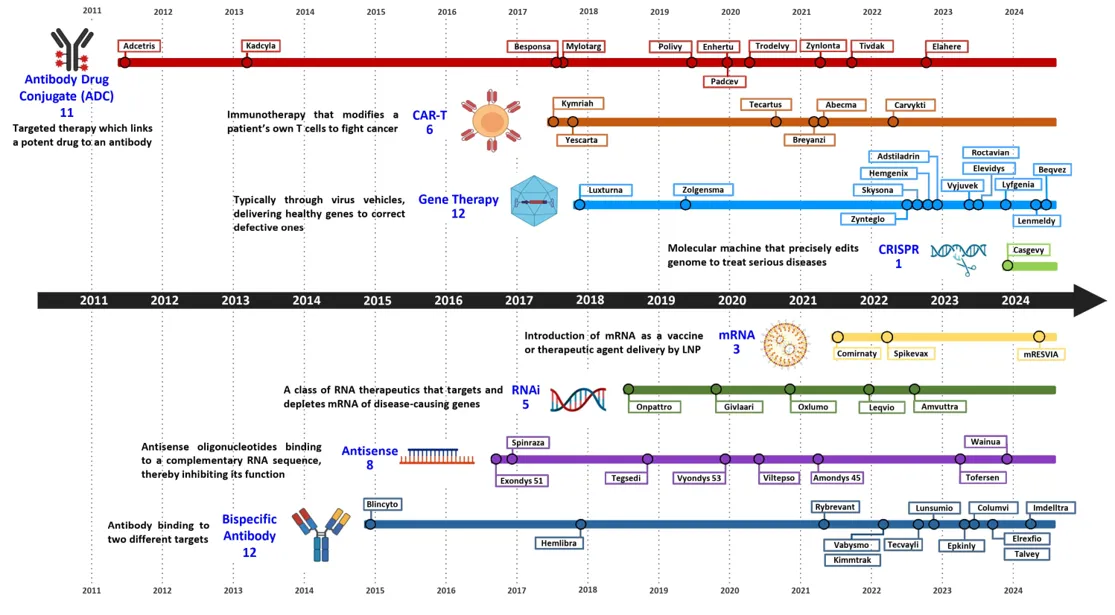
1. mRNA藥物的發展歷程和興起:近年來,mRNA技術的突破性進展推動了新型治療藥物的發展,如抗體藥物複合體(ADCs)、基因療法、嵌合抗原受體T細胞(CAR)療法、CRISPR 基因編輯療法、信使RNA(mRNA)療法、小干擾RNA (RNAi) 和反義寡核苷酸(ASOs) 等。2018年,首個基於RNA的藥物patisiran (Onpattro™)獲得美國食品藥品監督管理局(FDA)批准上市,這是該領域的重大里程碑。由於mRNA藥物的廣泛應用潛力和易於生產的特性,目前已啟動許多臨床試驗來評估 mRNA藥物和疫苗的療效。
2. mRNA的設計與儲存:探討三種不同類型的mRNA,這些mRNA已被應用於mRNA藥物的開發,包含非複製mRNA (nrRNA)、自我擴增mRNA (saRNA)和環狀mRNA (circRNA)。另一方面,mRNA-LNP在儲存和運輸過程中面臨保持穩定性的挑戰,主要由於水解和氧化反應引發的化學降解,導致mRNA骨架斷裂和二級結構改變。我們探討mRNA-LNP的儲存和冷鏈管理。例如以凍乾作為潛在解決方案,以增強穩定性、延長保存期、和擴大儲存溫度範圍。
3. 設計新型脂質用於LNP遞送系統:脂質奈米顆粒(LNPs)已成為遞送mRNA藥物的有效載體,可以保護mRNA免於降解並促進細胞攝取。LNPs通常由四種脂質成分組成:(1) 可離子化陽離子脂質、(2)輔助磷脂、(3)聚乙二醇化脂質、(4)膽固醇。可離子化陽離子脂質的設計對LNPs的遞送效率至關重要,其結構特性(如胺核心、可降解的酯基接頭和硫酯尾部)會影響LNPs的穩定性、細胞攝取和胞內體逃逸。研究發現,具有多尾脂質體、不飽和硫酯尾部、可自我降解的結構以及配體修飾的離子化脂質,可以顯著提高mRNA的遞送效率和靶向性。
4. LNPs的胞內體逃脫(endosomal escape):胞內體逃逸是決定核酸藥物遞送效率的關鍵因素。除了開發新型離子化脂質外,其他策略如使用β-榖固醇替代膽固醇、將中性輔助脂質DMG-PEG替換為帶負電荷的DMPE-PEG、以及使用含有磷脂酰乙醇胺(PE)的輔助脂質等,均可促進胞內體逃逸並提高mRNA的遞送效率。
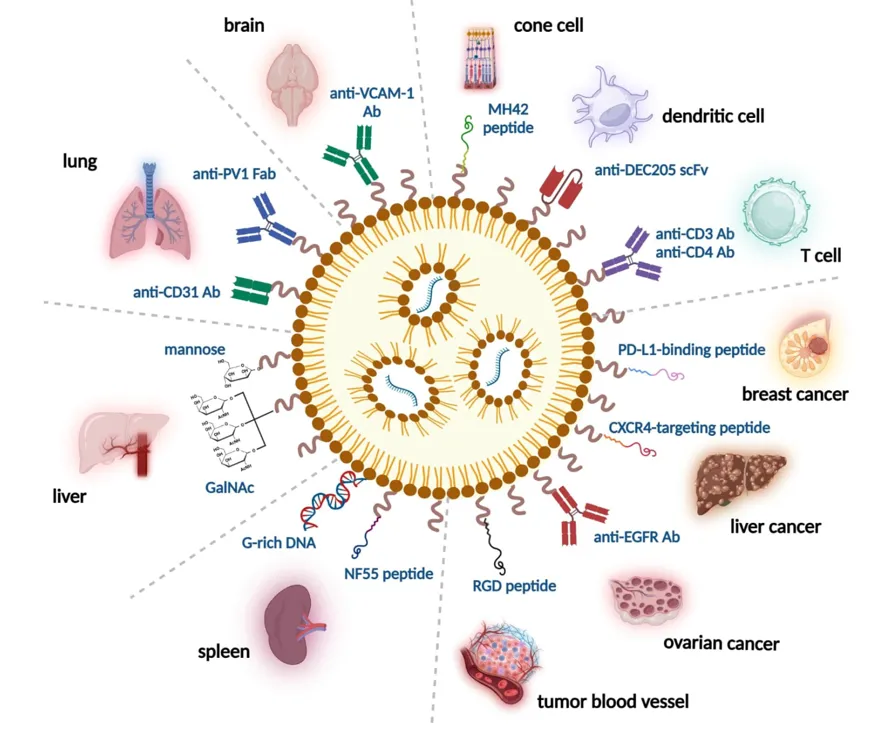
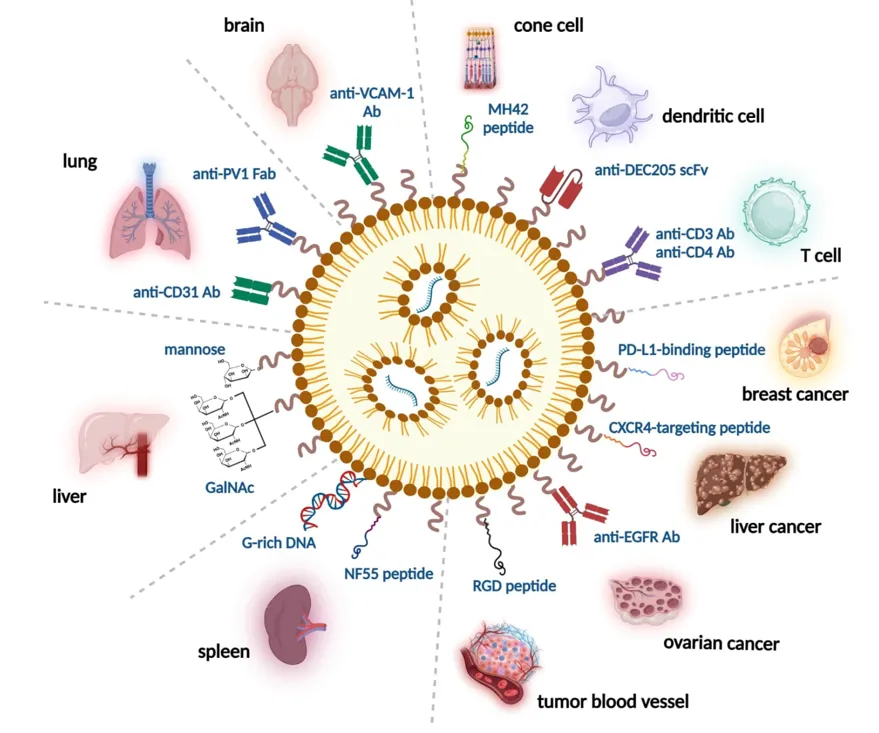
5. mRNA-LNPs的標靶遞送(targeting delivery):標靶遞送可以提高mRNA藥物的療效並降低副作用。配體介導的標靶遞送是將標靶配體,例如使用抗體、肽、適體、聚醣或小分子結合到LNPs表面,以實現對特定細胞或組織的遞送。研究顯示標靶配體可以成功地將mRNA-LNPs遞送到免疫細胞、腫瘤細胞和器官等目標部位。
6. 結論和展望:mRNA技術為藥物開發提供了一個變革性(game changer)的平台,但要充分發揮其臨床應用潛力,未來研究應致力於開發新型遞送系統、優化 LNPs 的組成和結構、以及探索更有效的標靶策略,有望能更安全有效地遞送mRNA,為治療各種疾病開闢新的格局。
此論文由中研院支持,細胞與個體生物學研究所吳漢忠特聘研究員團隊,以及化學研究所李文山研究員團隊共同撰寫,第一作者是生醫轉譯研究中心呂瑞旻研究助技師。